Healthy Longevity
Montag, 6.10.2025
©Foto: ClareM, Adobe Stock
Wir werden immer älter, doch gesunde Lebensjahre sind nicht selbstverständlich. „Healthy Longevity“ – die gesunde Langlebigkeit – rückt deshalb immer stärker in den Fokus von Forschung und Medizin. In diesem ersten von zwei Teilen zeigt dir Prof. Dr. Nixdorff, warum das Thema so aktuell ist und welche Ansätze neue Perspektiven auf Altern und Gesundheit eröffnen.
Es besteht eine absolute Hype zum Thema Healthy Longevity, i.d. gesunde Langlebigkeit. Wieso ist dies so? Sicher besteht eine Herausforderung im demographischen Wandel, der nicht nur eine immer höhere Lebenserwartung darstellt, sondern damit leider vergesellschaftet einen Paradigmenwechsel des Krankheitsgeschehen. Sind früher Menschen im heute erwarteten mittleren Lebensalter an Infektionskrankheiten gestorben, so kommen heute Menschen erst „in die Gelegenheit“, unter chronischen Krankheiten im letzten Lebensdrittel zu leiden. Der „Lifespan“ ging nicht automatisch mit dem „Healthspan“ einher. Um diesen „Gap“ zu schließen, sind sehr große Forschungsarbeiten unterwegs; auch Investoren scheuen – wie etwas im Silicon Valley – nicht vor Milliarden-Investitionen in dieses Thema zurück. Ein 1. Teil gibt erste Eindrücke dieser beeindruckenden Zukunftsmedizin; ein 2. Teil wird ganz aktuelle Entwicklungen und weitere Perspektiven darlegen.
Anti Aging-Medizin wurde aus USA kommend bereits vor ca. 20 -30 Jahren vorgestellt. Der Hype fußte zunächst auf hormonellen Substitutionen, da wichtige Hormone wie etwa Geschlechts- und Wachstumshormone mit dem Alter versiegen und hieran wesentlich Altern festgemacht wurde. Neben einer akademischen Alterungsmedizin / Gerontologie führte Anti Aging-Medizin ein von der Hochschulmedizin belächeltes Dasein, da evidente Daten spärlich blieben. Mehr wurden externe Maßnahmen der Kosmetik und plastische Eingriffe wie Injektionen von Botulinumtoxin (Botox), Hyaluronsäure oder auch chirurgische Korrekturen als DIE Anti Aging-Applikationen gepflegt.
Nunmehr erhält die umfänglichere Alterungsmedizin doch mehr allgemeines und auch wissenschaftliches Interesse. Im Rahmen des demografischen Wandels wird die erheblich abgenommene Mortalität (Sterblichkeit) (noch zu Fürst Bismarcks Zeiten wurden Menschen nur halb so alt wie wir heute; aktuelle mittlere Lebenserwartung nach dem Statistischen Bundesamt 2021 von Frauen 83,4 Jahre, von Männern 78,5 Jahre (1)) mit erhöhter Morbidität (Krankheitslast) erkauft. Heute bestehen nach dem „Centers of Disease Control and Prevention (CDC)“ bei 6 von 10 Erwachsenen chronische Erkrankungen, bei 4 von 10 sogar 2 und mehr (2).
Diese waren früher weniger bekannt, da die kürzere Lebensspanne diese degenerierenden Veränderungen gar nicht erreichte. Altern ist nicht – wie bislang „hingenommen“ – schicksalshaft. Diese Entwicklung wird von der Sozialpolitik- und wirtschaft nicht ausreichend reflektiert. Der daraus abzuleitende Paradigmenwechsel hieße, nicht mehr nur dem Leben mehr Jahre zu geben, sondern den Jahren mehr Leben.
Jenseits der sog. Versorgungsmedizin werden große Forschungsinvestitionen großer Konzerne wie Google, Microsoft, Facebook & Amazon im Silicon Valley vorgenommen, um sich dem Thema zukunftszugewandt zu stellen. TIME hatte schon 2013 darüber berichtet („Can Google solve death?“) (3).
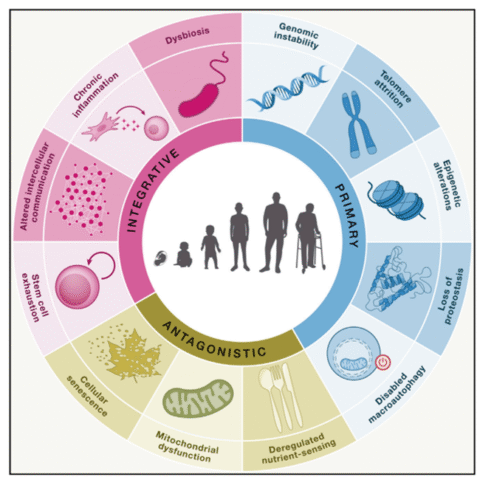
Was sind die aktuellen Erkenntnisse der Alterungsmedizin, aus denen zumindest in Ansätzen auch Möglichkeiten von Healthy Longevity-Maßnahmen erwachsen Hierzu wurden in einem namhaften Review die zellulär-molekularen „Hallmarks of Aging“ zusammengefasst.
Im Wesentlichen soll auf die 6 relevantesten Aspekte eingegangen werden (4,5):
1. Oxidativer Stress
Diese populärste Alterungstheorie wird auch „Freie Radikale-Theorie“ genannt. Freie Radikale sind Moleküle mit sehr reaktionsfähigen ungepaarten Elektronen. Um ein anderes Elektron zu gewinnen, reagiert das Molekül mit Zellorganellen als auch der DNA, was zu deren Schäden führt. Ursache sind exogene Faktoren wie UV-Strahlung, Umweltnoxen, Übergangsmetalle und Toxine, aber auch endogene „Abfallprodukte“ der mitochondrialen Energiegewinnung.
Als Antioxidantien wurde hochdosiert Vitamin A, C und E verwendet. Große, auch prospektive, Placebo-kontrollierte Studien der letzten Jahre erbrachten allerdings Ernüchterung. Hohe Dosierungen führten in Metaanalysen sogar zu erhöhter Infarkt- als auch Karzinomrate, was mit Einflussnahme in die sog. Apoptose (programmierter Zelltod) Erklärung findet (6). Das Hormesis-Prinzip besagt, dass ein gewisser Stress als günstig zu werten ist, die zelluläre Resilienz (Widerstandsfähigkeit) steigert (7). Nicht unerwähnt sei, dass isolierten Vitamine weniger antioxidative Bedeutung zukommt als dem natürlichen Obst, das auch sekundäre Pflanzenstoffe beinhaltet.
2. Mitochondriale Dysfunktion
Mitochondrien sind die Energielieferanten in den Zellen („zelluläre Atmungskette“), die einem eigenen Alterungsprozess unterliegen (8). Es kommt bei der Energiegewinnung – wie bei industriellen Kraftwerken – zu einem gewissen Schadstoffausstoß, was auch zu hochreaktiven, sog. Sauerstoffspezies führt. Die mitochondriale DNA ist dabei noch viel verletzlicher als die des Zellkerns; auch Reparaturmechanismen sind weniger effizient. Die Folge ist die Alterung der Zelle, der Mensch wird zunehmend müde und antriebsarm. Gezielte Supplementierungen sind vor allen Dingen Coenzym Q10 (Ubichinon), ein spezielles mitochondriales Antioxidans, oder auch L-Carnitin, ein Transportmolekül für Fettsäuren durch die Mitochondrienmembran. Im Sinne der o.g. Hormesis kann Kalorienrestriktion, oxidativer Stress oder niederschwellige Strahlenbelastungen gelten, die eine Reparaturantwort bzw. auch Bildung neuer Mitochondrien induzieren (9). Auch Resveratrol, Curcumin oder Quercetin sind zu nennen. Auch Medikamente wie Metformin oder Rapamycin können der Zelle einen Nahrungsmangel vortäuschen, der eine sog. Sirtuinaktivierung bewirkt (10). Derartige CR (caloric restriction)-Mimetika stellen derzeit die potentesten Substanzen mit potenziell lebensverlängernder Wirkung dar.
3. Chronische silent inflammation (unterschwelliges Entzündungsmilieu)
Prinzipiell sind entzündliche Reaktionen eine Antwort des Körpers auf eindringende Pathogene bzw. auf Gewebeverletzungen und von daher gesund. Allerdings ist die chronische Reaktion Ursprung fast aller chronischen Erkrankungen, auch der Atherosklerose (Gefäßwandverdickung und -verkalkung), die zu Herzinfarkt und Schlaganfall führt (10); aber auch von Krebserkrankungen (Inflammaging; 12). Proinflammatorische Zytokine (Entzündungsmoleküle) können im Serum gemessen werden und sind prognostisch relevant. Auch dem Darm und dessen Besiedlung mit Bakterien, dem sog. Mikrobiom, kommt eine Bedeutung zu, wenn nämlich dieser ungünsterweise durchlässig für Schadstoffe wird (leaky gut) und das Immunsystem kompromittiert (Immunoseneszenz; 13).
Wichtiger in einer Zeit der Pandemie der Adipositas ist allerding das Bauchfettgewebe als Ursprung von Zytokinen und Interleukinen, also Entzündungsmolekülen (14).
Schließlich werden die Aufräumarbeiten in den Zellen, die sog. Autophagie, nicht mehr wie im jungen Menschen erledigt. Es kommt zur Anhäufung von „Zellmüll“ (accumulation of biological garbage), der die Funktion der Zelle beeinträchtigt, immunologische Reaktionen hervorruft und damit chronische Entzündungen aktiviert (15).
Healthy Longevity-Konsequenz ist ein entzündungsarmer Lebensstil, insbesondere durch regelmäßiges Ausdauer- und Krafttraining als auch Kohlenhydrat-arme Ernährung. Die Gewichtsreduktion insbesondere die Reduktion des Bauchfettes sind anzustreben. Entzündliche Prozesse im Körper wie z.B. eine Periodontitis sollten saniert werden. Entzündungshemmende Medikamente sind noch im Forschungsstadium; die Acetylsalicylsäure (Aspirin) ist primärpräventiv nicht evident. Das o.g. Rapamycin als Senolytikum ist in der Erprobung (16).
4. Proteostaseverlust
Proteine werden als Alterungsfaktor nicht ausreichend abgebaut und die verbleibenden geschädigten Proteine verursachen degenerative Erkrankungen. Ein Beispiel ist die Alzheimer-Demenz, in dem Fall die Akkumulation von Amyloid-Plaques im Gehirn. Auch beim Morbus Parkinson finden sich ganz typische Proteinablagerungen, hier die sog. Lewy-Körperchen um sog. dopaminerge Nervenzellen herum, weswegen die Patienten Dopamin-haltiger Medikamente bedürfen.
Zukünftige Abhilfe kann hier einer Stimulation des o.g. Autophagie-Prozesses zukommen, der ja durch Kalorienrestriktion positiv beeinflusst werden kann. Dies kann durch Aktivierung der ebenfalls o.g. Sirtuine erfolgen, eine Stimulation kann offenbar durch Rapamycin erfolgen, dass tatsächlich in experimentellen Studien beeindruckend die Lebenszeit verlängern konnte (17). Auch Spermidin wies beeindruckende Effekte auf (18), was bereits als Supplement erhältlich ist.
Ein weiterer Proteaseeffekt ist die Glykierung, i.e. Verzuckerung von Proteinen (advanced glycation endproducts (AGE)), insbesondere bei zu starkem Zuckergenuss oder bei Diabetikern. Jeder Hausarzt misst dies am verzuckerten Hämoglobin (HbA1c). Plastisch stelle man sich die „schmierige“ Zuckerschicht eines verdunsteten Zuckerwasserglases vor. Hier bleibt die Healthy Longevity-Empfehlung von low carb, also zuckerarmer Ernährung. Weiterhin kommt dem Medikament Metformin eine Anti Aging-Wirkung zu (erste Ergebnisse der TAME (Targeting Aging with Metformin)-Studie sind ermutigend, eine erste unmittelbare medikamentöse Anti-Aging-Studie (20)).
5. Genetik und Epigenetik
Es wurde genetische Polymorphismen, Abweichungen, entdeckt, die großen Einfluss auf das Altern haben. Experimentell hat die Aktivierung der Gene daf-2 bzw. daf-16 im Fadenwurm (C. elegans) eine Verdoppelung der Lebenszeit zur Folge (21). Beim Menschen ist besser das Forkhead-Box-O-3 Gen (FOXO3) belegt. Umgekehrt ist der ApoE4 Polymorphismus bekannt, der ungünstig neurodegenerative Erkrankungen provoziert.
Wichtiger in der letzten Zeit ist allerdings die Epigenetik geworden. Es ist ein Bindeglied zwischen Umwelt und Erbanlagen, eine komplexe genetische Verstoffwechselung (DNA-Methylierung). Damit stellt sie auch eine Diagnostikmöglichkeit von Alterung über einen einfachen Blut- oder Speicheltest dar (Horvarth clock; 22). Es ist bekannt, dass epigenetische Konstellationen durch Sport und Ernährung (erneut Kalorienrestriktion) spezifisch beeinflusst werden können (23). Folsäure als Methylgruppendonator kann offenbar epigenetisch regulieren, aber auch sekundäre Pflanzenstoffe mit Polyphenolstruktur (24).
6. Telomerenverkürzung
Telomere als kodierende DNA-Gerüst sind seitens diesen eine „biologische Uhr“, wie dies zuerst von dem Biogerontologen Hayflick in den 60er Jahren bereits beschrieben wurde (25). Keim- und Stammzellen sind in der Lage, eine Telomerenverkürzung auszugleichen und somit dem Alterungsprozess entgegenzuwirken. Auf diese Zellen bezogen, besteht prinzipiell Unsterblichkeit. Ansonsten ist die Teilungsfähigkeit von Zellen begrenzt; nach Hayflick liegt dies bei 50- – 60-mal, danach sterben sie ab (Hayflick-Limit). Bei jeder Teilung nehmen die Telomerenenden immer ein wenig ab. Damit ist die Telomerenlänge ein Anzeiger der noch verbliebenen Lebenszeit. Wichtig ist, dass Einflüsse wie Stress, Rauchen, Übergewicht, Bewegungsarmut den Verkürzungsprozess beschleunigen. Auch bekannt ist, dass umgekehrt gesunde Lebenshaltung die Verkürzung wieder verlängern kann, also damit aktives Anti Aging darstellen kann (26). Telomerenlänge kann heute von Genetiklaboren bestimmt werden. Es stehen seit Kurzem sog. Telomeraseaktivatoren wie z.B. das Phytoextrakt Astragalus membranaceus oder aktuell der Wirkstoff TA-65® zur Verfügung. Das Krebsrisiko scheint entgegen anfänglicher Befürchtungen nicht erhöht zu sein, da Krebszellen oft erhöhte Telomerasen besitzen.
In summa summarum ergeben sich sehr ermutigende Möglichkeiten der Healthy Longevity-Medizin. Größere Studien werden derzeit durchgeführt, um tatsächlich belegen zu können, dass die Herausforderung chronischer Erkrankungen im Sinne der Lebensqualitätsverbesserung beantwortet werden kann. Wir wollen den mittlerweile erzielten, vielen Jahren mehr Leben geben, wenn sich sicherlich auch dem Leben in Zukunft noch weitere Jahren geben lassen werden …
In diesem Sinn: Bleiben Sie gesund und vital!
Soweit für heute und voller Lebensfreude bis zum nächsten Mal …
Ihr

Prof. Dr. med. U. Nixdorff, F.E.S.C.
Internist, Kardiologe, Sportmediziner

Professor Dr. med. Uwe Nixdorff ist Experte für Herzerkrankungen. Der Facharzt für Innere Medizin mit den Schwerpunkten Kardiologie und Sportmedizin ist ärztlicher Geschäftsführer und Gründer des European Prevention Centers (hier geht’s zur Website) sowie ärztlicher Geschäftsführer von Hanako Health (hier geht’s zur Website).
Referenzen
- Bundesamt für Statistik: Sterbefälle und Lebenserwartung. https://www.destatis.de/DE/Themen/Gesellschaft-Umwelt/Bevoelkerung/Sterbefaelle-Lebenserwartung/_inhalt.html; aufgerufen im www am 11.12.2022
- Centers of Disease Control and Prevention (CDC): Chronicc Diseases in America. https://www.cdc.gov/chronicdisease/resources/infographic/chronic-diseases.htm; aufgerufen im www am 11.12.2022
- TIME, September 30, 2013: Can Google solve death? https://content.time.com/time/covers/0,16641,20130930,00.html; aufgerufen im www am 11.12.2022
- López-Otin C, Blasco MA, Partridge L, et al. The hallmark of aging. Cell 2023; 186:243-78
- Kleine-Gunk B. Biologisches Altern. Aus: Präventions- und Anti Aging-Medizin; Hrsg Kleine-Gunk B, Wolf A. Springer Verlag 2021
- Bjelakovic G, Nikolova D, Gluud LL, et al. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and metaanalysis. JAMA 2007; 297: 842-57
- Calabrese EJ, Mattson MP. Hormesis provides a generalized quantitative estimate of biological plasticity. J Cell Commun Signal 2011; 5:25-38
- Miquel J, Economos AC, Fleming J, et al. Mitochondrial role in cell aging. Exp Gerontol 1980; 15:575-91
- Haigis MC, Yankner BA. The aging stress response. Mol Cell 2010; 40:333-44
- Hawley, SA, Ross FA, Chevtzoff C, et al. (2010) Use of cells expressing gamma subunit variants to identify diverse mechanismen of AMPK activation. Cell Metab 2010; 11:554-65
- Ross R. The pathogenesis of arterosclerosis: a perspective to the 1990s. Nature 1992; 362: 801-9
- Franceschi C, Bonafe M, Valensin S, et al. Inflamm-aging. An evolutionary perspective on immuno senescence. Ann N Y Acad Sci 2000; 908:244-154
- Biagi E, Candela M, Franceschi C, et al. The aging gut microbiotia: new perspectives. Ageing Res Rev 2011; 10:428-9
- Grant RW, Dixit VD. Mechanisms of disease: Inflammasome activation and the development of type 2 diabetes. Front Immunol 2013; 4: 50-8
- Dall’Olio F, Vanhooren V, Chen CC, et al. (2013) N-glycomic biomarkers of biological aging and longevity: a link with inflammaging. Ageing Res Rev 2013; 12:685-98
- Baker DJ, Wijshake T, Tchkonia Z, et al. Clearance of p16INK4a-positive senescent cells delays ageing-associated disorders. Nature 2011; 479:232-6
- Harrison DE, Strong R, Sharp ZD, et.al. (2009) Rapamycin fed late in life extends lifespan in genetically heterogeneous mice. Nature 2009; 460:392-5
- Eisenberg T, Knauer H, Schauer A, et al. (2009) Induction of autophagy by spermidine promotes longevity. Nat Cell Biol 2009; 11:1305-14
- Vistoli G, De Maddis D, Cipak A, et al. (2013) Advanced glycosilation and lipoxidation end products (AGEs and ALEs): an overview of their mechanism of formation. Free Radic Res 2013; 47: 3-27
- Kulkarni AS, Gubbi S, Barzilai N. Benefits of Metformin in Attenuating the Hallmarks of Aging. Cell Metab 2020; 32:15-30
- Kenyon C, Chang J, Gennsch E, et al. (1993) A C. elegans mutant that lives twice as long as wild type. Nature 1992; 366:461-4
- Horvath, S. DNA methylation age of human types and tissues and cell types. Genome biology 2013; 14:3156-62
- Issa JP. Epigenetic variation and human disease. J Nutr 2002; 132:2388S-92S
- Mathers JC. Nutritional modulation of ageing: genomic and epigenetic approaches. Mech Ageing Dev 2006; 127584-9
- Hayflick L, Moorhead PS. The serial cultivation of human diploid cell strains. Exp Cell Res 1961; 25:585-621
- Werner C, Fürster TM, Widmann T et al. (2009) Physical exercise prevents cellular senescense in circulating leukocytes and in the vessel wall. Circulation 2009; 120:2438-47
Andere Artikel
17. November 2025
Stoffwechseltraining
Finde die „richtige“ Strategie für dein persönliches Stoffwechseltraining! Im 3. Teil seiner Reihe verrät dir Dr. Gimbel, was zu tun ist.
21. August 2025
Stoffwechseltraining
Was bringt dir eine Stoffwechselanalyse? Erfahre dazu mehr im 2. Teil zum Thema Stoffwechseltraining ➔ Dr. Gimbel gibt Dir einen Einblick
11. Februar 2025
Stoffwechseltraining
Wie ist es um Deine Energiebilanz bestellt? Erfahre dazu mehr im 1. Teil zum Thema Stoffwechseltraining ➔ Dr. Gimbel gibt Dir einen Einblick


